和鉑醫藥-B(02142.HK)公佈HBM4003臨床I期數據,突顯療效及安全性優勢
HONG KONG, Sep 16, 2021 – (亞太商訊) – 9月13日,和鉑醫藥發佈公告,稱其在研藥物HBM4003針對實體瘤的I期劑量爬坡臨床試驗取得了積極結果,相關臨床數據摘要已於2021年9月召開的歐洲腫瘤內科學會(ESMO)年會上發佈。據公司披露,今年9月該在研藥物再次獲得中國國家藥品監督管理局批准兩項針對新適應症的IND許可,而公司亦正在多個晚期實體瘤開展該產品的單藥和聯合用藥的全球臨床開發。
 |
 |
 |
作為擁有全人源重鏈抗體平台和免疫細胞銜接器雙抗平台的生物醫藥公司,和鉑醫藥基於自身稀缺技術平台和強大研發實力而打造的下一代抗CTLA-4全人源重鏈抗體HBM4003是目前抗CTLA-4藥物領域少見的優質產品。
CTLA-4靶點優越性顯現,市場快速增長
由於CTLA-4是T細胞反應的主要負調控因子之一,抗CTLA-4抗體為許多疾病包括腫瘤的免疫治療提供了新的方法,這使得其在當期眾多靶點中備受關注。
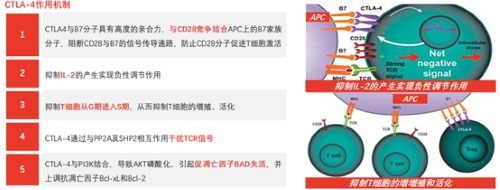
CTLA-4,又稱抗細胞毒性T淋巴細胞相關抗原-4,是由CTLA-4基因編碼的T細胞表面跨膜蛋白,主要在活化的CD4+ T淋巴細胞及調節性T細胞表面表達。CTLA-4通過競爭性結合CD80和CD86而抑制CD28的激活,抑制T細胞的增殖和活化。
基於該技術原理,CTLA-4靶點藥物的適應症領域範圍廣闊,治療效果可觀,目前已經獲批和在研的適應症包括:黑色素瘤、肺癌、胃癌、腸癌、腎細胞癌、肝癌、子宮肌膜癌、前列腺癌等。
廣闊的適應症範圍帶來的是該靶點藥物急速增長的市場空間。目前唯一上市的抗CTLA-4抗體是伊匹木單抗(Yervoy)。Yervoy在美國已獲批的適應症包括黑色素瘤和腎細胞癌。2012年至2020年,Yervoy的銷售收入由7.06億美元增加至16.82億美元。
根據弗若斯特沙利文報告,全球抗CTLA-4藥物銷售收入於2030年預期將達到83億美元。在中國,抗CTLA-4藥物市場預期將於2030年達到17億美元,2024年至2030年的複合年增長率為30.6%。
如此高的市場增長速度,吸引了一眾具備強大實力的玩家。目前,中國有多款涉及CTLA-4靶點的藥物處於IND申報流程。種類包含單克隆抗體、雙特異性抗體和融合蛋白類產品。在適應症分佈方面,實體瘤為目前主流的研究領域。
而抗CTLA-4抗體藥物的研發過程中,安全性是一大關鍵因素。和鉑醫藥HBM4003近日公佈的臨床I期數據顯示,其在療效和安全性相比已上市的Yervoy都具備明顯優勢,是十分值得關注的藥物之一。
臨床數據公佈,HBM4003有效性安全性表現優異
根據弗若斯特沙利文報告,安全性更好,療效更好,適應症更廣的創新型抗CTLA-4抗體的推出有望推動全球抗CTLA-4藥物市場的增長。
HBM4003是和鉑醫藥通過其專有的HCAb技術平台開發的一種全人源、單克隆、重鏈抗CTLA-4抗體。
此次公佈的I期研究數據也是新一代抗CTLA-4全人源單克隆重鏈抗體(HCAb)在實體瘤中的首個臨床證據。基於HBM4003全人源和僅重鏈的稀缺結構及特殊的藥代動力學及藥效動力學機制,使其在安全性方面表現突出。
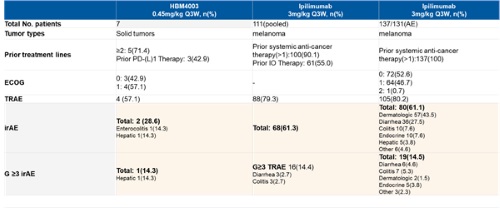
數據顯示,臨床試驗未發現肺、腎、心臟及內分泌系統毒性。而最常見的治療相關不良事件是腹瀉及小腸結腸炎,最常見的免疫相關不良事件是腹瀉/小腸結腸炎以及皮疹,未發現3級以上治療相關不良事件。所有的不良事件均為可控,並可以通過常規干預迅速恢復。
對於患者而言,藥物安全性是用藥時需要考慮的最關鍵的因素之一。據初步的安全性數據顯示,HBM4003的安全性優於當前唯一上市藥物伊匹木單抗。免疫治療相關的不良反應(irAE)的發生率僅為14.3%,明顯低於伊匹木單抗的61.3%。基於已有臨床數據,伊匹木單抗的治療相關不良反應廣泛涉及肺、腎、肝及內分泌等重要器官及系統,HBM4003的治療不良反應為腹瀉/或腸炎,具有明顯安全性區別。
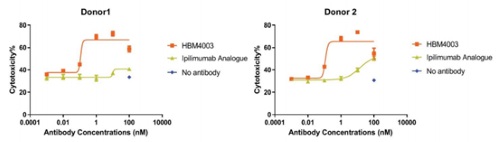
從備受關注的療效方面來看,全人源重鏈抗體結構使得產品獲得了更好的腫瘤穿透性。而由於HBM4003的Fc區進行過改造,顯著增強了ADCC功能,從而提升了對於Treg細胞的清除能力。通過清除Treg,HBM4003能夠特異性地誘導T細胞在腫瘤微環境中被激活,而這正是產生強效抗癌免疫反應的關鍵步驟。
體外ADCC殺傷試驗數據顯示,HBM4003對比伊匹木單抗有更高效的Treg清除活性,預示了其在臨床抗腫瘤的優勢。
而初步療效數據,也證實了這一點。數據顯示臨床I期試驗中,其中一名80歲的男性受試者,過往已接受過包括多西他賽、卡巴他賽、比卡魯胺的多線治療,並未達到預期治療效果,但之後接受HBM4003治療出現明顯療效。HBM4003給藥劑量為0.6 mg/kg三週一次的治療。在第六周時,相較基線,其高度特異性的腫瘤生物標誌-前列腺特異性抗原水平(PSA)降低超過50%。針對已經接受過多種療法的受試者,HBM4003依然能使患者產生應答,在當前鼓勵藥物研發應以臨床價值為導向的環境下,這意味著其未來在市場中或將具備較強競爭力。
而另外一名64歲的亞洲男性肝癌受試者,在開始HBM4003治療16周後,靶病變縮小53.3%,腫瘤直徑由受試之初的22.5釐米減至10.5釐米,甲胎蛋白(AFP)由170μg/L減至9μg/L;治療24周後,靶病變縮小超過60%,非靶病灶全部消失。
基於HBM4003臨床I期的積極數據,其後續試驗已在全面加速推進中。據公司透露,目前HBM4003已佈局多瘤種的全球試驗以及聯合療法相關試驗,預計2022年將有多項數據公佈。而由於CTLA-4與PD-(L)1抑制劑組合適應症探索數目眾多,可以預見未來HBM4003或將擁有更廣闊的市場空間。
小結
值得注意的是,HBM4003療效和安全性的優勢,得益於公司強大的抗體研發平台。目前在世界範圍內,和鉑醫藥的HCAb平台是為數不多可以產生全人源重鏈抗體並擁有全球知識產權保護的抗體平台。
HBM4003的I期試驗階段性積極成果,證實了該平台的優越性。和鉑醫藥擁有H2L2, HCAb及HBICE®抗體平台,基於多個技術平台公司開發了豐富的產品管線,其中不乏如HBM1020(B7H7)、HBM7008(B7H4x4-1BB)等全球首創性產品,也有如HBM1022(CCR8)及HBM7020(BCMAxCD3)等通過差異化結構設計有望成為潛在同類最佳的產品。而作為培育HBM4003的搖籃及創新工具,HCAb平台的應用範圍還包含了CAR-T、CAR-NK、診斷抗體、偶聯物載體等一系列領域,可謂前景廣闊。
可以預見,公司應用多個全人源抗體平台,同時結合自身強大的研發能力打造的新一代腫瘤免疫基石療法,除HBM4003外,在未來或將有更多極具潛力藥物值得期待。
Copyright 2021 亞太商訊. All rights reserved. www.acnnewswire.com

AMICIS 與插畫家合作推出高品質玻璃滑鼠墊!

來自智慧型手機 RPG 遊戲《忍術大師 千手神樂 NEW LINK》的靈宿格物館中學的「Gekko」公仔,穿著原創的兔子服飾!

請注意她喝了酒後微醺的表情♪'Azure Lane「重型櫻花編隊航空母艦」Shinano「現已推出」Filling Oborozuki'皮膚的人偶!

迷人的身體是真正的 Ikitousen!來自「Shin Ikkitousen」的「Kanu Unchou」再次成為兔子Ver!

新系列 "NEW CRASH "正式上市! PPE Kokoro Shinozaki & Kitaro 的休閒 x 帥氣 "NEW" 風格!

THE KING OF FIGHTERS '98 中的女格斗家 「不知火舞」 加入 美少女 系列! 現在在 Amiami 接受預購!

















